体内CAR-T技术:细胞治疗的范式转变
重新定义癌症治疗的未来:从体外制备到体内直接生成的革命性跨越
执行摘要
体内CAR-T技术通过将CAR基因或mRNA直接递送至患者体内,在生理环境中原位生成CAR-T细胞,旨在颠覆传统CAR-T疗法复杂、昂贵且耗时的体外制备流程。该技术在递送载体(如靶向LNP和工程化慢病毒)、基因编辑(如CRISPR敲除PD-1)和靶向策略上取得了显著进展。
初步临床试验在血液肿瘤(如多发性骨髓瘤)中显示出令人鼓舞的疗效和可控的安全性,并已开始向实体瘤领域拓展。其"现货型"特性有望极大简化生产、降低成本,吸引了包括阿斯利康、艾伯维在内的大型药企通过合作与并购积极布局。
尽管仍面临体内递送效率、长期安全性和持久性等挑战,但体内CAR-T技术正以前所未有的速度从实验室走向临床,预计将在未来十年内重塑细胞治疗产业格局。
关键指标
1. 技术发展:体内基因编辑与递送的核心突破
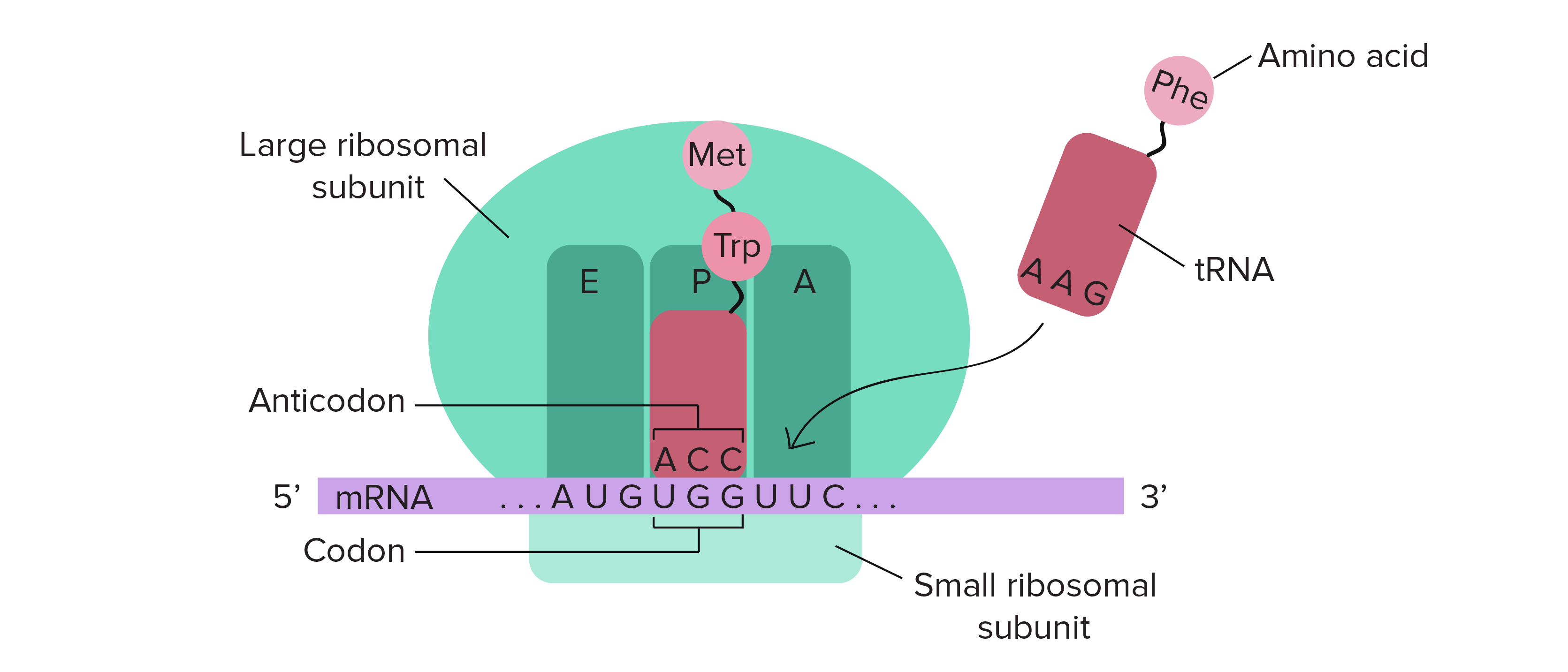
体内CAR-T技术,即体内嵌合抗原受体T细胞疗法,代表了细胞与基因治疗领域的一次范式革命。与传统CAR-T疗法(Ex vivo CAR-T)需要从患者体内分离T细胞,在体外进行基因修饰、扩增后再回输的复杂流程不同,体内CAR-T旨在通过特定的递送系统,将编码CAR的基因(如mRNA或DNA)直接递送至患者体内的T细胞,使其在生理环境中直接转化为能够识别并攻击肿瘤细胞的CAR-T细胞[274]。
1.1 新型递送载体:从病毒到非病毒系统的演进
递送系统是体内CAR-T技术的核心与基石,其性能直接决定了CAR基因能否被有效、安全地递送至目标T细胞。目前,研究人员正在探索多种递送载体,主要分为病毒载体和非病毒载体两大类。
病毒载体
病毒载体,如慢病毒(Lentivirus)和腺相关病毒(AAV),因其高效的基因转导能力而被广泛研究。慢病毒能够高效地将目的基因整合到宿主细胞的基因组中,从而实现CAR的长期稳定表达。
非病毒载体
非病毒载体,特别是脂质纳米颗粒(LNP)和外泌体,因其较低的免疫原性、易于大规模生产和更高的安全性而备受关注。
| 特性 | 病毒载体 (慢病毒/AAV) | 非病毒载体 (LNP/外泌体) |
|---|---|---|
| 转染效率 | 通常较高,可实现长期稳定表达 | 效率不断提升,但通常低于病毒载体 |
| 基因整合 | 慢病毒:整合到基因组;AAV:通常不整合 | 不整合到基因组 |
| 表达持久性 | 长期 (慢病毒) 或瞬时 (AAV) | 瞬时 (mRNA) 或需特定策略实现长期表达 |
| 安全性 | 存在插入突变和免疫原性风险 | 安全性更高,免疫原性低 |
| 生产成本 | 高昂,工艺复杂 | 相对较低,易于规模化生产 |
| 装载能力 | AAV容量有限 (<5kb) | 理论上可装载更大分子 |
1.2 基因编辑技术:提升CAR-T细胞功能与安全性
基因编辑技术是体内CAR-T疗法的另一核心支柱,它不仅能将CAR基因导入T细胞,还能对T细胞的基因组进行精细修饰,以增强其抗肿瘤功能、延长其体内存续时间并降低毒副作用。
CRISPR/Cas9
敲除PD-1、TIM-3和LAG-3等T细胞耗竭相关基因,增强抗肿瘤持久性
碱基编辑
"无痕"编辑单个碱基,降低染色体易位风险,提高安全性
TALEN技术
构建多靶点CAR和"安全开关",提高特异性并降低毒性
基因编辑在安全性提升中的应用
-
脱靶效应最小化:优化gRNA设计和使用高保真度Cas9变体,降低意外DNA切割风险
-
安全开关:引入iCasp9等自杀基因,在严重副作用时可通过AP1903激活诱导CAR-T细胞凋亡[183]
-
逻辑门控:设计AND门控CAR-T,需同时识别两个抗原才激活,提高肿瘤特异性
1.3 转染效率与特异性提升策略
在体内CAR-T技术中,实现高效且特异的体内T细胞转染是确保疗效和安全性的关键。由于T细胞在体内的分布和状态复杂,如何将基因编辑工具精准地递送到目标T细胞,并确保高效的基因转导,是该领域面临的核心技术难题。
靶向递送策略
通过在载体表面展示能够特异性结合T细胞表面标志物(如CD3或CD4/CD8)的抗体或配体,可以实现对T细胞的靶向递送。
外泌体递送系统
外泌体作为一种天然的纳米级细胞外囊泡,因其良好的生物相容性、低免疫原性和高效的细胞间物质传递能力,被认为是极具潜力的体内CAR-T递送载体。研究表明,CAR-T细胞自身能够分泌携带CAR蛋白的外泌体,这些"CAR-Exos"能够像CAR-T细胞一样识别并杀伤肿瘤细胞,但其毒性显著降低[136]。
2. 临床应用与疗效:从血液肿瘤到实体瘤的探索
体内CAR-T技术的临床应用正处于从概念验证向广泛探索的快速发展阶段。目前,绝大多数临床试验仍集中在血液系统恶性肿瘤,如多发性骨髓瘤和B细胞淋巴瘤,这些领域已经积累了初步但令人鼓舞的疗效和安全性数据。
2.1 针对血液系统恶性肿瘤的临床试验进展
多发性骨髓瘤:EsoBiotec的ESO-T01疗法突破
EsoBiotec公司开发的ESO-T01疗法是体内CAR-T领域的一个里程碑。该疗法通过单次静脉输注,利用慢病毒载体将编码抗BCMA CAR的mRNA递送到患者体内,直接重编程T细胞以攻击多发性骨髓瘤细胞。
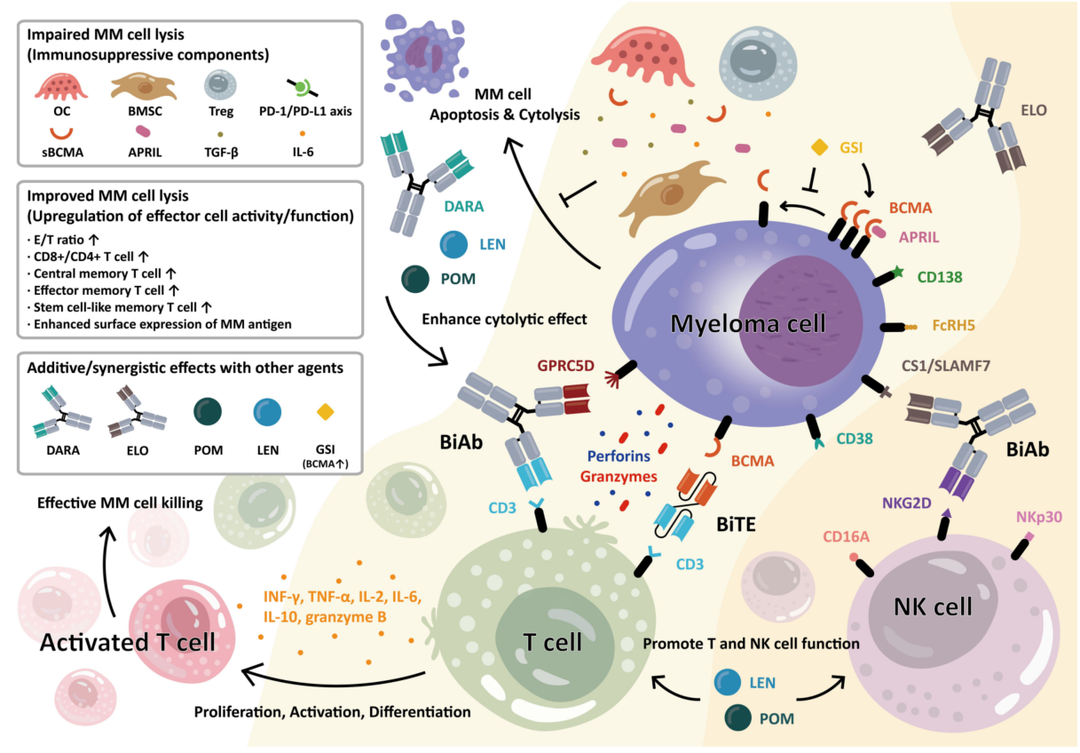
体内CAR-T疗法在复发/难治性多发性骨髓瘤中展现惊人潜力
B细胞淋巴瘤进展
吉利德科学公司通过其子公司Kite Pharma,在2025年以3.5亿美元收购了专注于体内CAR-T开发的Interius BioTherapeutics公司,其领先候选药物INT2104正处于针对B细胞恶性肿瘤的I期临床试验阶段[285]。
急性淋巴细胞白血病
由于ALL病情进展迅速,传统CAR-T疗法长达数周的生产周期可能成为患者的"生死瓶颈"。体内CAR-T技术有望通过"现成"的注射剂型,极大地缩短治疗等待时间。
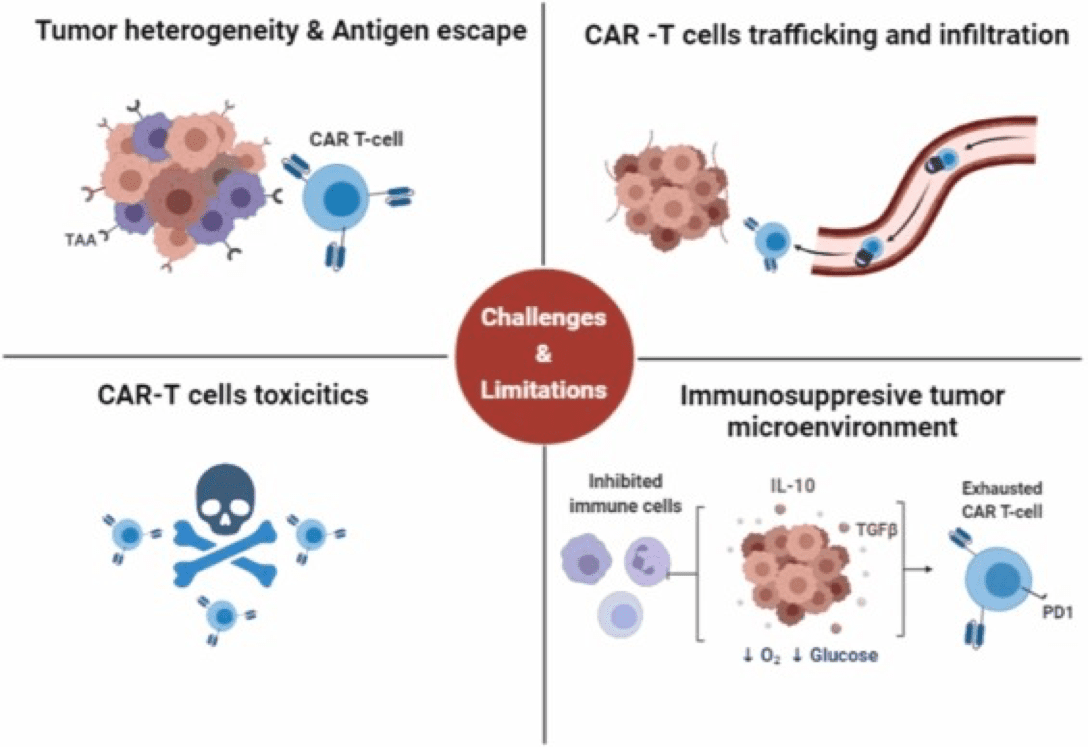
2.2 攻克实体瘤的挑战与策略
实体瘤治疗的三大核心障碍
双靶点CAR策略
通过设计能够同时识别两个不同抗原的CAR-T细胞,可以有效降低因单一抗原丢失导致的复发风险。宾夕法尼亚大学团队开发的同时靶向EGFR和IL13Rα2的双靶点CAR-T疗法在复发性胶质母细胞瘤中取得突破性进展[320]。
"装甲型"CAR设计

在CAR-T细胞中额外表达能够增强其功能的分子,如细胞因子(如IL-12)或趋化因子受体。这些"装甲"可以帮助CAR-T细胞更好地浸润肿瘤组织,抵抗TME的抑制。
联合治疗策略
将体内CAR-T疗法与免疫检查点抑制剂(如抗PD-1/PD-L1抗体)联用,是目前研究最为广泛的组合之一。免疫检查点抑制剂可以解除TME对CAR-T细胞的抑制,恢复其抗肿瘤活性。
2.3 体内CAR-T与传统CAR-T的比较
体内CAR-T优势
- 简化生产流程,消除复杂细胞分离和体外培养
- 显著降低成本,预计降至3-5万美元[306]
- 缩短治疗周期,从数周缩短至数天
- 提高可及性,可在社区医院实施
体内CAR-T挑战
- 体内递送效率和特异性有待优化
- 长期安全性数据仍需积累
- CAR-T细胞持久性可能有限
- 剂量控制更具挑战性
| 特性 | 体内CAR-T | 传统体外CAR-T |
|---|---|---|
| 生产模式 | 体内直接生成,标准化"现货型"产品 | 体外个体化制备,自体细胞产品 |
| 治疗周期 | 数天,可立即给药 | 数周,需等待制备 |
| 生产成本 | 预计显著降低 | 极其高昂(数十万美元) |
| 可及性 | 高,有望普及至基层医院 | 低,局限于大型医疗中心 |
| 剂量控制 | 更具挑战性,依赖体内生成 | 精确,可回输预定数量的细胞 |
| CAR表达 | 瞬时 (mRNA) 或长期 (病毒) | 长期稳定表达 |
| 主要挑战 | 体内递送效率、长期安全性、持久性 | 制造失败风险、高昂成本、等待时间 |
3. 产业化现状与未来趋势
体内CAR-T技术正从实验室走向市场,其产业化进程正在加速。全球范围内的生物技术公司和大型制药企业纷纷布局这一前沿领域,通过自主研发、战略合作和并购等方式,推动技术的快速迭代和临床转化。
3.1 市场规模与增长预测
载荷类型分布
mRNA编码CARs预计将保持最快增长势头
区域市场格局
北美
强大的研发基础设施和完善的监管体系
欧洲
首个欧洲体内CAR基因疗法试验获批
亚太
中国、日本、韩国等国家投入巨大
3.2 主要参与企业与竞争格局
领先企业
大型药企布局
新兴公司与技术平台
Umoja Biopharma
专有VivoVec平台,与艾伯维合作开发肿瘤靶向体内CAR-T疗法
3.3 商业化路径与挑战
合作与并购
大型药企与生物技术公司的战略合作是推动体内CAR-T技术商业化的主要模式。大型药企拥有资金和商业化网络,生物技术公司具备创新技术。
监管审批
体内CAR-T疗法需要建立新的监管框架和评价标准,特别是针对mRNA递送系统和体内基因编辑的安全性和有效性评估。
生产制造
建立标准化、可规模化的生产体系是关键挑战。体内CAR-T的生产质量控制、稳定性测试和储存运输等环节需要新的技术标准。
商业化面临的主要挑战
技术挑战
- • 体内递送效率和特异性优化
- • CAR-T细胞持久性和功能稳定性
- • 基因编辑安全性和脱靶效应控制
- • 剂量控制和个体化治疗方案制定
商业挑战
- • 生产规模化和质量控制标准化
- • 成本控制和价格策略制定
- • 市场准入和医保覆盖
- • 与传统CAR-T疗法的竞争定位
结论
体内CAR-T技术代表了细胞治疗的范式转变,有望解决传统CAR-T疗法面临的高成本、复杂制备和有限可及性等核心挑战。通过将CAR基因或mRNA直接递送至患者体内,在生理环境中原位生成CAR-T细胞,该技术能够极大地简化生产流程、缩短治疗周期、降低制造成本。
目前,体内CAR-T技术在递送载体(如靶向LNP和工程化慢病毒)、基因编辑(如CRISPR敲除PD-1)和靶向策略上取得了显著进展。初步临床试验在血液系统恶性肿瘤中显示出令人鼓舞的疗效和可控的安全性,并已开始向实体瘤这一更大挑战领域拓展。
关键成功因素
-
递送系统效率和特异性的持续优化
-
基因编辑安全性的进一步提升
-
临床疗效和安全性的充分验证
-
标准化生产和监管框架的建立
未来展望
体内CAR-T技术正以前所未有的速度从实验室走向临床,预计将在未来十年内重塑细胞治疗产业格局。随着技术不断成熟和临床数据积累,该技术有望成为癌症治疗的重要武器,为更多患者带来希望。